Molekülde Polarlık Apolarlık
Molekülde Polarlık Apolarlık; Çoğu zaman polar bağ ve apolar bağ ile karıştırılmıştır.
Öncelikle polar kovalent bağ ve apolar kovalent bağ nedir bunlardan bahsedelim sonra Molekülde Polarlık Apolarlık konusuna değinelim.
Polar kovalent bağ: Farklı iki ametal atomu arasında elektronların ortaklaşa kullanılması ile oluşan kimyasal bağa denir.
Örnek : H-Cl, H-Br, H2O, NH3, BH3 vs
Apolar kovalent bağ: Aynı iki ametal atomları arasında elektronların ortaklaşa kullanılması ile oluşan kimyasal bağdır.
N2 , O2, Br2, F2, H2(H-H) örnekler çoğaltılabilir.
Molekülde Polarlık Apolarlık
Merkez Atom : Bir molekülde genelde sayıca daha az ve diğer atomların bağlandığı atomdur.
CH4 sayıca az olan C merkez atomdur. NH3 Sayıca az olan N merkez atom.
**Merkez atom değerlik elektron sayısı kadar aynı atomla bağ yapmış ise molekül apolardır.
CH4 ü inceleyecek olursak. 6C : 1s2 / 2s2 2p2 değerlik elektron sayısı 4 ve C 4 tane aynı atomla(H) bağ yapmış molekül apolardır. Burada C-H arasındaki bağ polar iken CH4 molekülü apolardır.
BH3 inceleyecek olursak. 5B :1s2 / 2s2 2p1 Değerlik elektron sayısı 3 ve B 3 tane aynı atomla (H) bağ yapmış molekül apolardır.
**Molekül iç bağları yalnızca apolar kovalent bağ olan moleküller —->apolar moleküldür.
N2 , O2, Br2, F2, H2 bu şekilde apolar kovalent bağlı bileşiklerin tamamının molekülüde apolardır.
Merkez atom değerlik elektron sayısından daha az bağ yapmış yada farklı atomlarla bağ yapmışsa molekül polardır.
Molekülde Polarlık Apolarlık Açıklamalı Örnekler
NH3 inceleyecek olursak. Merkez atom sayıca Az olan N atomudur. 7N : 1s2 / 2s2 2p3 değerlik elektron sayısı 5 ancak yaptığı bağ sayısı NH3 te de görüldüğü üzere 3 tane H bağlı. Merkez atom değerlik elektron sayısından daha az bağ yapmış olduğu için molekül polardır.
H2O inceleyecek olursak. Merkez atom sayıca Az olan O atomudur. 8 O :1s2 / 2s2 2p4 değerlik elektron sayısı 6 ancak yaptığı bağ sayısı H2O da da görüldüğü üzere O ya 2 tane H bağlı.Merkez atom değerlik elektron sayısından daha az bağ yapmış olduğu için molekül polardır.
CH3F bileşiğini inceleyecek olursak. 6C : 1s2 / 2s2 2p2 değerlik elektron sayısı 4 ve C 4 tane farklı atomlarla (H ve F ) bağ yapmış molekül polardır.
** 2 atomlu polar kovalent bağlı moleküller polar moleküllerdir.
H-Cl, H-Br, H-I vs
Bu konunun farklı anlatım metodları vardır. Hibritleşme konusunu bilmeyenler için kısaca bu şekilde özetleyebiliriz. Yine geometrik şekillerle de anlatımı mevcuttur.
Molekülde Polarlık Apolarlık ve Lewis Nokta Yapısı
Molekülde polarlık apolarlığı lewis nokta yapısı üzerinden örneklendirelim
Örnek; NH3 molekülünün polar mı yoksa apolar mı olduğunu inceleyelim.
7N : )2 )5
1H: )1
NH3 bileşiğinde sayıca az olan Element N atomu olduğu için merkez atom N dir. Ametaller Son yörüngedeki elektron sayısını 8 e tamamlayan sayı kadar bağ yapar. Lewis yapısında son yörüngedeki elektronların elementin sembolünün etrafına yazıldığını biliyoruz.

Azotun 5 elektronunun 3 bağ oluşumuna katılacaktır. 2 elektron bağ yapımına katılmayacaktır.

NH3 bileşiğinin lewis yapısından da anlaşılacağı üzere merkez atom olan N üzerinde 2 elektron bağ oluşumuna katılmamıştır. Dolayısıyla NH3 bileşiği polar moleküldür.
Polar ve apolar molekül örnekleri için tıklayınız.
Molekülde Polarlık Apolarlık konusu ile ilgili çözümlü sorular için tıklayınız.


Ocak 30, 2019 @ 5:38 pm
Çok guzel anlatım cok isime yaradı teşekkürler
Mart 24, 2019 @ 10:07 am
Teşekkürler
Mart 22, 2019 @ 4:30 pm
Konu ile ilgili kafamdaki soru işraretlerini kaldıran bir konu anlatımı olmuş çokk teşekkürler.
Mart 24, 2019 @ 10:07 am
Faydalı olabildiysek ne mutlu bize. Başarılar
Mart 30, 2019 @ 7:10 pm
gerçekten tüm konuyu anlamamı sağladı. çok teşekkürler.
Mart 30, 2019 @ 11:24 pm
Yorumunuzla faydalı olabildiğimizi anlamak çok güzel. Başarılar dileriz.
Nisan 5, 2019 @ 3:13 am
Ödevime çok yardımcı oldunuz. Aynı zamanda kafama takılan soruların cevabını buldum teşekkürler
Eylül 5, 2020 @ 12:54 am
Ödevi araştırırken bi kere okumussundur umarım. Başarılar
Kasım 26, 2020 @ 3:31 pm
Gerçekten harika bir anlatım çok teşekkürler
Kasım 26, 2020 @ 7:19 pm
Yorumunuz için çok teşekkürler. Başarılar dileriz
Şubat 20, 2022 @ 6:34 pm
Ödevim için gerekli tüm bilgiler vardı çok teşekkür ederim.
Aralık 10, 2022 @ 1:59 am
Harika anlatmişsiniz emeğinize sağlık
Şubat 13, 2023 @ 8:30 am
Çok teşekkürler uzun zamandır anlamadığım konuyu 30 saniyede anladım
Mart 22, 2023 @ 11:18 pm
Merhabalar anlamadığım bir nokta var eğer molekülde bir merkez atom yoksa nasıl karar veriyoruz cevap verirseniz sevinirim
Mart 23, 2023 @ 10:20 am
Yukarıdaki anlatımda da bahsetmişim kısaca burada da bahsedelim;
Merkez atom olmayan;
Molekül iç bağları yalnızca apolar kovalent bağ olan moleküller apolar moleküldür. Başka bir ifadeyle; Molekülde polar kovalent bağ yoksa molekül apolardır.
Örnek ; N2 , O2, Br2, F2, H2 bu şekilde apolar kovalent bağlı bileşiklerin tamamının molekülüde apolardır. Bunlar neden apolar; bağa katılan elektronlar her bir atom tarafından dengeli bir şekilde kullanılmaktadır.
Örnek ; HCl Merkez atom yok molekül polar mı apolar mı?
Burada bağ elektronları Cl atomu tarafından çok kullanıldığı için Cl atomu kısmi negatif yuklu, H kısmı pozitif yukludur. Dolayısıyla bağ elektronları dengeli kullanılmamış Molekül polardır.
C2H6 Molekülü polar mı apaolar mı inceleyecek olursak;
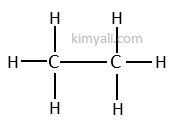
Öncelikle molekülün açık formulunu yazacak olursak;
Herbir bağı fizikten F kuvveti olarak düşünürsek;
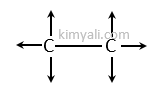
F kuvvetlerinin bileşkesini alırsak bileşke kuvvet sıfır olur. Yani bağ elektronları dengeli bir şekilde kullanılmıştır. Dolayısıyla C2H6 molekülü apolardır.
Mart 23, 2024 @ 1:26 am
güzel içerik.